
UNIDAD 5
El carbono y la química orgánica


ISOMERÍA

Es la propiedad de algunos compuestos químicos de tener la misma fórmula molecular pero estructuras o disposiciones diferentes. Esto significa que, aunque los átomos son los mismos y en la misma cantidad, se organizan de formas distintas, dando lugar a compuestos con propiedades físicas, químicas o biológicas diferentes. Es como si fueran "variaciones" de la misma fórmula.
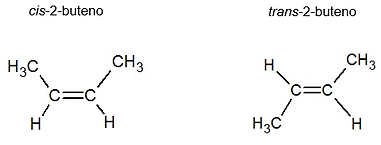
ISOMERÍA ESTRUCTURAL

Es un tipo de isomería donde los compuestos tienen la misma fórmula molecular, pero difieren en la forma en que sus átomos están enlazados o conectados. Esto da lugar a diferentes estructuras y propiedades químicas.
Se clasifica en:
-
De cadena: Diferente disposición de los átomos de carbono en la cadena principal.
-
Ejemplo: Butano (CH₃CH₂CH₂CH₃) e isobutano (CH₃-CH(CH₃)-CH₃).
-
-
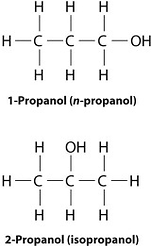
De posición: El grupo funcional está en diferentes posiciones dentro de la cadena.
-
Ejemplo: Propanol (CH₃CH₂CH₂OH) y isopropanol (CH₃CHOHCH₃).
-
De función: Diferente tipo de grupo funcional.
-
Ejemplo: Etanol (CH₃CH₂OH) y metoximetano (CH₃OCH₃).
-
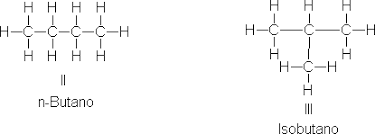


ESTEREOISOMERÍA
Es un tipo de isomería donde los compuestos tienen la misma fórmula molecular y conectividad de átomos, pero difieren en la disposición espacial de sus grupos o átomos. Esta diferencia en el espacio puede afectar sus propiedades físicas, químicas y biológicas. Un ejemplo común son los isómeros cis-trans y los enantiómeros (isómeros ópticos).
GEOMÉTRICA O CISTRANS
Es un tipo de isomería donde los compuestos tienen la misma fórmula molecular y conectividad de átomos, pero difieren en la disposición espacial de sus grupos o átomos. Esta diferencia en el espacio puede afectar sus propiedades físicas, químicas y biológicas.
-
Isómeros cis: Los grupos sustituyentes están en el mismo lado del doble enlace o anillo.
-
Isómeros trans: Los grupos sustituyentes están en lados opuestos del doble enlace o anillo.


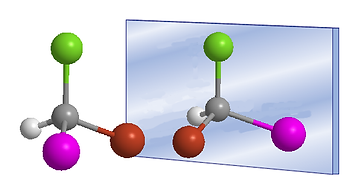
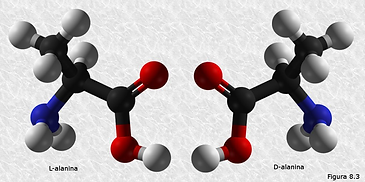
ISOMERÍA ÓPTICA
Es un tipo de estereoisomería en la que los isómeros tienen la misma fórmula molecular y la misma disposición de átomos, pero difieren en la manera en que interactúan con la luz polarizada. Estos isómeros son conocidos como enantiómeros.
Los enantiómeros son imágenes especulares no superponibles, como las manos derecha e izquierda. Cada uno rota el plano de la luz polarizada en direcciones opuestas: uno en sentido horario (dextrógiro) y el otro en sentido antihorario (levógiro).
Esta isomería se debe a la presencia en la molécula de átomos de carbono asimétricos, o sea, unidos a cuatro sustituyentes distintos, como ocurre en el ácido láctico.
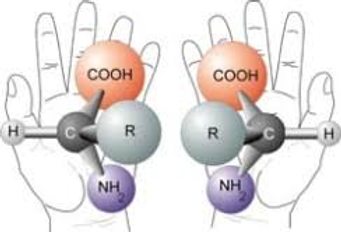
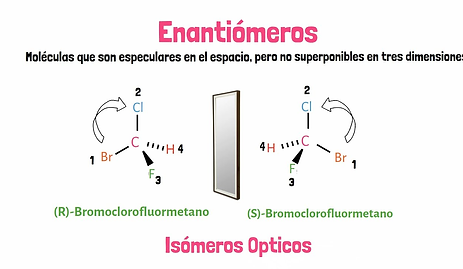
La diferencia estructural entre los dos isómeros ópticos radica en que sus moléculas no son superponibles, ya que guardan entre sí la misma relación que un objeto y su imagen reflejada en un espejo.
Las moléculas cuya imagen especular no es superponible a ellas las denominamos quirales.
A la mezcla en igual concentración de las disoluciones de los dos isómeros la llamamos mezcla racémica o racemato y es ópticamente inactiva por compensación de los dos giros en sentido contrario.
Una molécula puede tener varios carbonos asimétricos, y en función del numero de estos aumenta el numero de isómeros ópticos posibles. Si en la molécula hay n átomos de C asimétricos, el número máximo posible de isómeros es 2n
PRACTICA LO APRENDIDO AQUÍ



